構造生物化学研究室では、興味深いタンパク質を精製し、結晶化することが日常の実験です。その後、X線や中性子を結晶に当て、タンパク質の構造を原子のレベルで明らかにします。構造だけでなく、反応や作用メカニズムについて、様々な手法を用いで明らかにしていきます。
自然はなぜその構造を選択したのか?その謎に迫り、様々な病気の原因究明、治療薬開発、環境保全のため、その知識を社会に還元します。
TEL. 0294-38-5041
〒316-8511 茨城県日立市中成沢4-12-1
具体的な研究内容Research Projects
- 1. 毛髪キューティクル角化に関わるタンパク質群の研究
- みなさんは、「櫛でとかせない頭髪症候群」ってご存知ですか?
PAD3は毛髪(図1-1)のキューティクル細胞というところにたくさんあるS100A3という小さなタンパク質を少し変形させる反応をするタンパク質・酵素です。この酵素(PAD3)はカルシウムイオンがあると働き始めます。S100A3の中にあるアルギニンというアミノ酸の1つをシトルリンというアミノ酸に変換する化学反応を行います。そうすると、不思議!S100A3は集合してちょうど二倍の大きな構造になります。ただ単に二倍の大きさになるだけでなく、形も大きく変わります。また、さらに不思議なのは、S100A3はカルシウムイオンを良くくっつけるようになるのです。つまり、細胞内にカルシウムイオンが余分にある状態になると、PAD3が働いてS100A3を使ってカルシウムを集めるようなことがキューティクル細胞内では行われていることになります。また、さらに不思議なのはこの構造変化によりS100A3は亜鉛イオンも良くくっつけるようになります(図1-2)(Kizawa, et al. The Journal of Biological Chemistry, 283, 5004-5013, 2007)。亜鉛やカルシウムを良くくっつける生理的な意義はまだ未解明のことが多いのですが、両方のイオンとも様々なタンパク質とくっついて、そのタンパク質達をコントロールするイオンです。この不思議な現象は「角化(かくか)」と呼ばれる髪の毛が出来上がるときに起こることがわかっているため、正常で健康な毛髪をつくり出すのに必須の生理現象のようでです。現に、花王の研究グループによると、S100A3やそのシトルリン化の割合が少ないと、髪の毛はダメージを受け、また、それは加齢とともに顕著となることがわかっています(Takahashi, et al., Journal of Cosmetic Dermatology, 15, 211-218, 2016)。

- 図1-1. 毛髪の構造
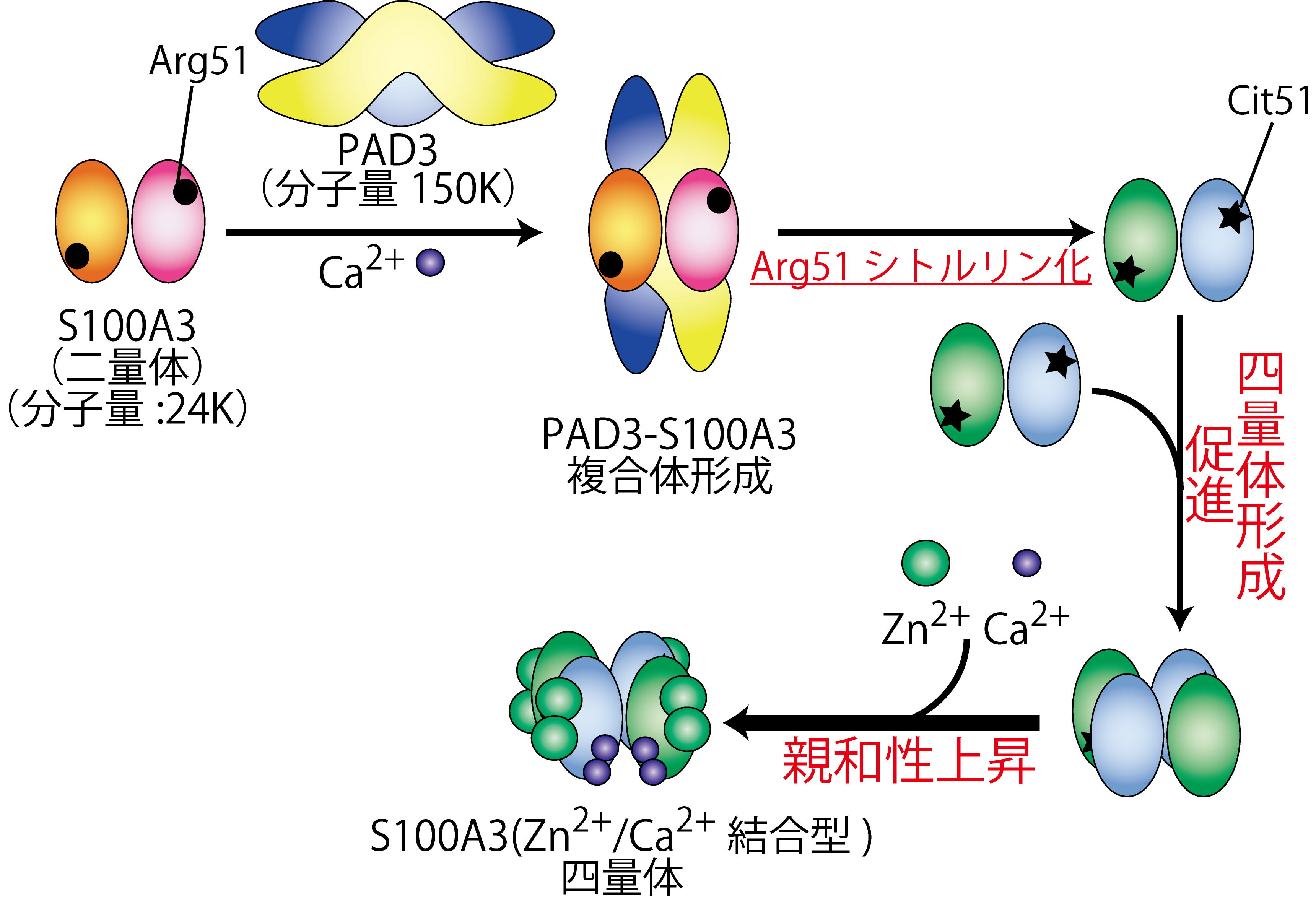
- 図1-2. 酵素PAD3によるS100A3タンパク質の翻訳後修飾と構造・機能変化
また、毛髪内にはPAD3の他によく似た酵素(アイソザイム)、PAD1とPAD2も存在しています。S100A3と一緒に存在しているのはPAD3が圧倒的に多いのですが、PAD1やPAD2もS100A3と出会うときがあります。試験管の中で反応させるとPAD1やPAD2はS100A3の中の1つのアルギニンだけでなく、全て(S100A3の中には4つアルギニンがある)のアルギニンをシトルリンに変えます。なぜでしょうか。とても不思議です。PAD1もPAD2もPAD3も非常に似ているのですが。私達のグループでは、このような酵素反応の違いを原子どうしの関わり方で解明しようとしています。
- 2. 光合成色素フィコシアノビリンを合成する酵素の反応のメカニズムを水素原子レベルで解明する。
- 太陽の光を集める色素。これを作っている酵素は不思議な反応をコントロールしている。その不思議なメカニズムを解明したい。
植物や紅藻類、シアノバクテリアなどの光合成生物は、光を集めるためにアンテナのような役割を果たすタンパク質を持っています。高等植物は集光性複合体(LHC)を発達させ、光を集める色素としては「クロロフィル」を有しています。一方、紅藻やシアノバクテリアでは「フィコビリソーム」というタンパク質複合体が発達し、効率よく光を集めエネルギーを生産している。フィコビリソームの中でまさにアンテナのように外に飛び出しているタンパク質群の中には「フィコビリン」と呼ばれる色素が含まれています。フィコビリンの一つ、「フィコシアノビリン」は、PcyAというタンパク質に生合成される。また、フィコシアノビリンは高等植物の「フィトクローム」と呼ばれるタンパク質に内包され、こちらでは、開花や落葉・紅葉などを制御する光を受け取り信号を伝達する「センサー」としての役割を担っています。
PcyAの反応はとても独特です。ヘム(我々のヘモグロビンの中にも含まれている鉄を含んだ化合物)の分解産物であるビリベルジン(以下、BVと略します)を還元してフィコシアノビリンを作ります。フェレドキシンという小さな電子伝達タンパク質から電子をもらい、ヘムの還元によりビリン色素を作る酵素をフェレドキシン依存性ビリン還元酵素(Ferredoxin-Dependent Bilin Reductase; FDBR)と総称しますが、FDBRの中で唯一、D環を還元できる酵素です。また、D環のビニル基を還元した後、A環も還元するという、酵素としては珍しく2か所を順番を間違えずに還元反応します(図2-1)。
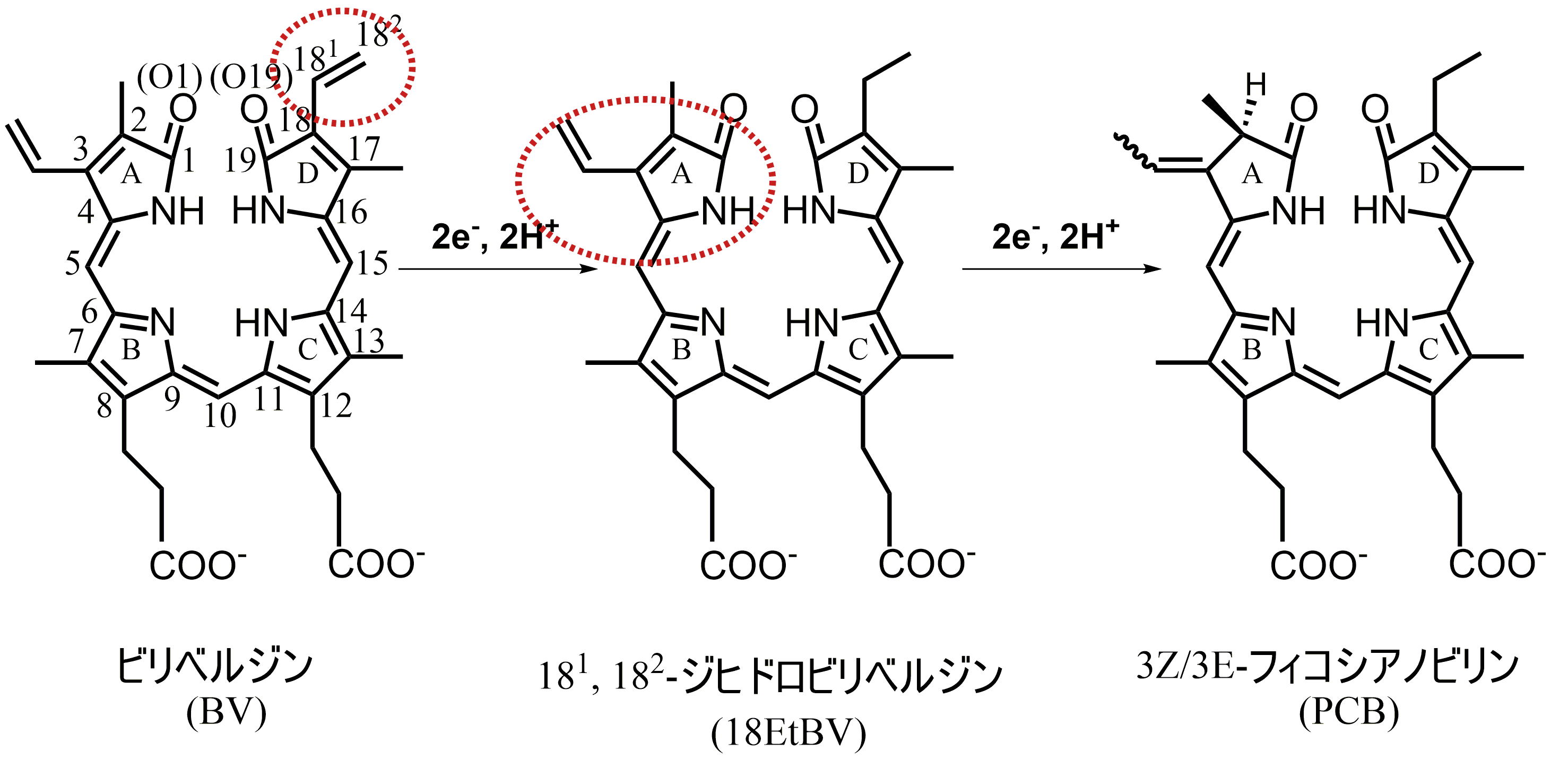
- 図2-1. 酵素PcyAによるフィコシアノビリンの生合成反応
私達は2015年にPcyAとBVが結合した状態の構造を中性子で明らかにして、水素の立体的な結合位置を可視化することに成功しました(Unno, M., et al., J. Am. Chem. Soc. 137, 5452-5460, 2015)。反応のスタート時の水素の立体的な位置がわかったわけです。X線ではわからなかったことがいろいろわかってきました。今後は、反応途中や、酵素に変異を入れた時の水素の位置を解明し、どのように「還元反応」が進行していくか、ということを水素原子レベルで解明します。
酵素の神秘を解き明かすことは、このような重要な光合成色素を人間が効率よく合成する方法を提示することになることもあるでしょうし、遺伝子改変した菌によって、様々な機能性の色素を創らせることも可能になるかもしれません。
- 3. 放射線による二重鎖切断DNAの修復を担うタンパク質の原子レベルの立体構造解析。
- 放射線によってDNAがダメージを受ける場合もあるが、ヒトにはそれを修復する能力が備わっている。その修復を担うタンパク質の構造を明らかにしたい。
放射線に被ばくするとDNAの損傷が起きて、様々な障害の原因となることは皆さんもご存知だと思います。ヒトにはDNAの損傷に対する修復機構が備わっており、最も重篤なダメージの一つである二重鎖切断を修復することさえできます。その二重鎖切断を「相同組換え」という精度の高い経路で修復するタンパク質群が存在します。そのメンバーの一つのタンパク質について研究を行っています。本学理学部の田内先生らのグループと共同で行っている研究では、1は、DNAの二重鎖切断が起こると、細胞核の中の損傷部位にこのタンパク質が集合するという特徴があり、修復の経路に関わっています。
その一方で、哺乳類由来のそのタンパク質の構造はわかっていません。構造がわかれば、その機能部位にハマる化合物の設計ができ、放射線によるDNA二重鎖切断の修復を人工的に調節できる可能性があります。
そのような化合物の探索を視野に、私達は、田内研究室との共同研究で、このタンパク質の立体構造をできるだけ正確に精密に構造解析しようと考えています。

図3-1. DNA切断のイメージ。生物には修復する機構が備わっている。
- 4. ヒトが痛みや温度などの刺激を感知する時に働くタンパク質の構造的特徴をできるだけ高い解像度で明らかにする研究。
- 様々な刺激により活性化されるTRPチャネル。このチャネルのサブファミリーの中はTRPA1とTRPV1はそれぞれ感受する温度や刺激が異なるが、共通した「アンキリンリピートドメイン」を持っている。どのように違いが生み出されているか?構造から解明したい。。
一方で、私達はTRPV1という他のサブグループに属するTRPチャネルにも注目しています。TRPV1は43℃いじょうの温度を感知します。唐辛子の成分であるカプサイシンによって活性化されることも知られています。このTRPV1もN末端側に「アンキリンリピートドメイン」を持っています。ただし、TRPA1に比べると小さなものになります。同じ「辛い」という日本語での表現をする感覚でも、働いているタンパク質は違うものなのですね。
これらのアンキリンリピートドメインの秘密に迫りたいと思います。
バナースペース
海野昌喜研究室
〒316-8511
茨城県日立市中成沢4-12-1
TEL 0294-38-5041
FAX 0294-38-5041